Academia GoFIR ha realizado una revisión estadística sobre las últimas seis convocatorias, ofreciendo unos datos muy útiles para cualquier farmacéutico opositor al cuerpo de Farmacéuticos Titulares del Estado.

A diario recibimos en la academia numerosas preguntas de farmacéuticos interesados en iniciar la oposición al cuerpo de Farmacéuticos Titulares del Estado. Muchas de ellas son de tipo estadístico: «¿y cuanta gente se presenta?», «tengo 40 años, soy demasiado mayor?», «acabo de terminar la carrera, tengo poca experiencia para empezar el estudio?»; «¿cuántas horas de estudio debo dedicar al día?»; «yo trabajo, sería compatible con el estudio?», ¿cuántos años de estudio se necesitan para poder conseguir plaza?», etc…
En base a los datos de las últimas seis convocatorias, y a los datos del perfil de opositor que arranca en GoFIR su preparación, hemos podido elaborar una infografía resumida con la que poder tener una fotografía mental del perfil de opositor que se presenta a nuestro cuerpo de funcionarios. A continuación los exponemos:

Como primer dato, el/la farmacéutico/a que escoge preparar esta oposición es mujer (en un 86%), frente a hombres (un 18%). Aunque estos porcentajes están muy correlacionados con las matrículas en la propia carrera de Farmacia. Las edades más frecuentes son entre 23 y 40 años, siendo los mayores de 40 un 23% aproximadamente.
La principal motivación por la que un farmacéutico se decide a opositar sigue siendo la estabilidad laboral, económica y la conciliación laboral y familiar (89%), frente a que las diversas actividades que se realizan dentro de nuestro cuerpo sean pura vocación (11%).

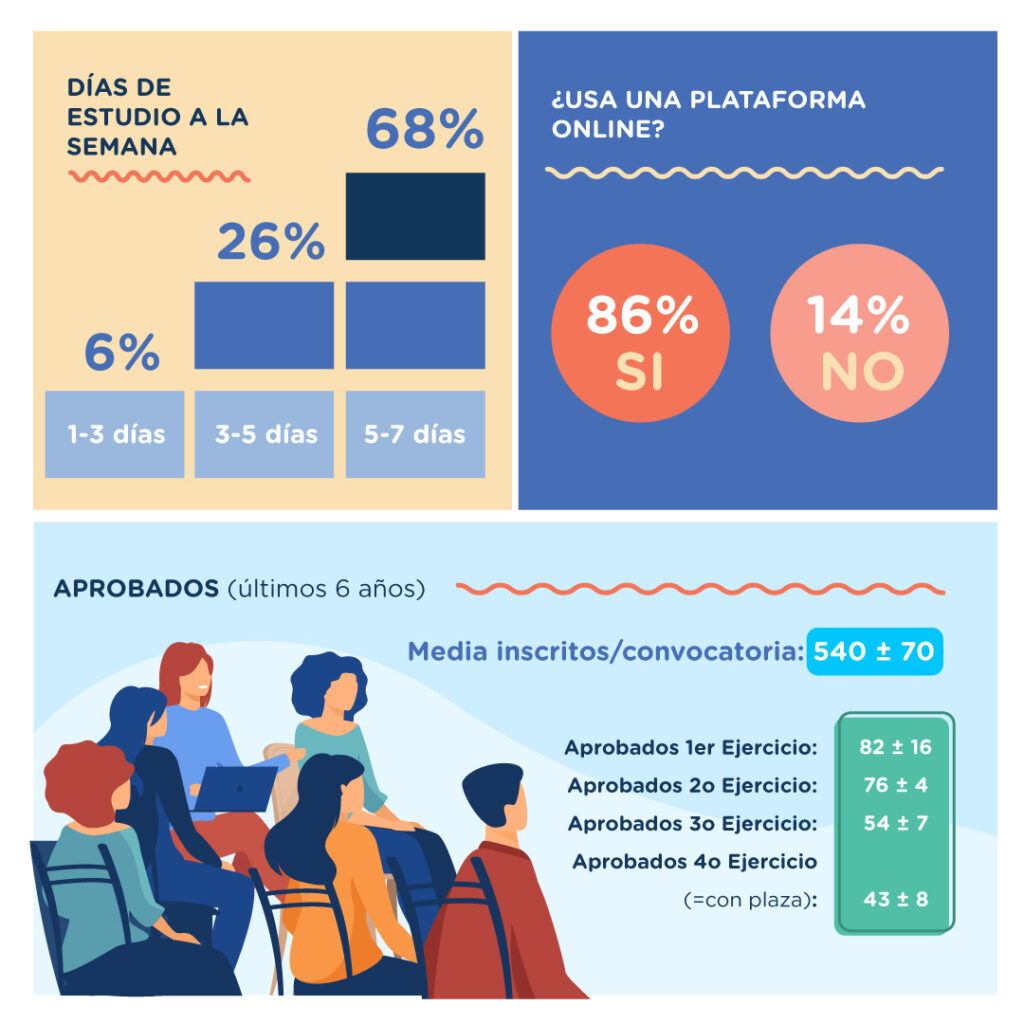
Una pregunta muy frecuente es la de compaginar el trabajo con el estudio. Para nuestra oposición, la inmensa mayoría lo hace compaginando con un trabajo (75%) que le permita disponer de varias horas de estudio al día. ¿Cuántas horas? Pues partiendo de nuestra experiencia con alumnos, y también como opositores que fuimos, no creemos que una persona media pueda aprovechar más de 8-9 horas al día de estudio productivo. Teniendo este número como un máximo, nosotros consideramos y recomendamos al menos 4-5 horas de estudio al día, durante 5-6 días a la semana. Esto sería un mínimo. En la infografía se puede comprobar que la inmensa mayoría de nuestros opositores se sitúan entre las 3 y las 6 horas de estudio diarias (53%), y también superan los 5 días de estudio a la semana (68%).
Los futuros alumnos, en correos y llamadas para información, casi siempre nos comentan su trayectoria profesional previa: si vienen de la oficina de farmacia (42%), del hospital o formación FIR (20%), de la industria farmacéutica (18%) o de la universidad (16%). Podemos comprobar cómo el perfil del farmacéutico que lleva ya unos años trabajando en oficina de farmacia sigue siendo el más frecuente de cara a dar el paso y convertirse en opositor.
Al ser una oposición del Estado (con destinos en todo el territorio nacional), la inmensa mayoría se decanta por una formación tele-presencial (88%) de calidad, que no le reste tiempo de estudio a la semana, y que ofrezca una buena plataforma en la que se integre todo lo necesario (actualización activa de temario y documentación adjunta, plataforma de preguntas test individualizada, simulacros generales, contacto directo con todos los tutores de diferentes áreas del temario, tablón de novedades y alertas, videoclases, clases telepresenciales, y formación específica en casos prácticos (4º ejercicio de la oposición).
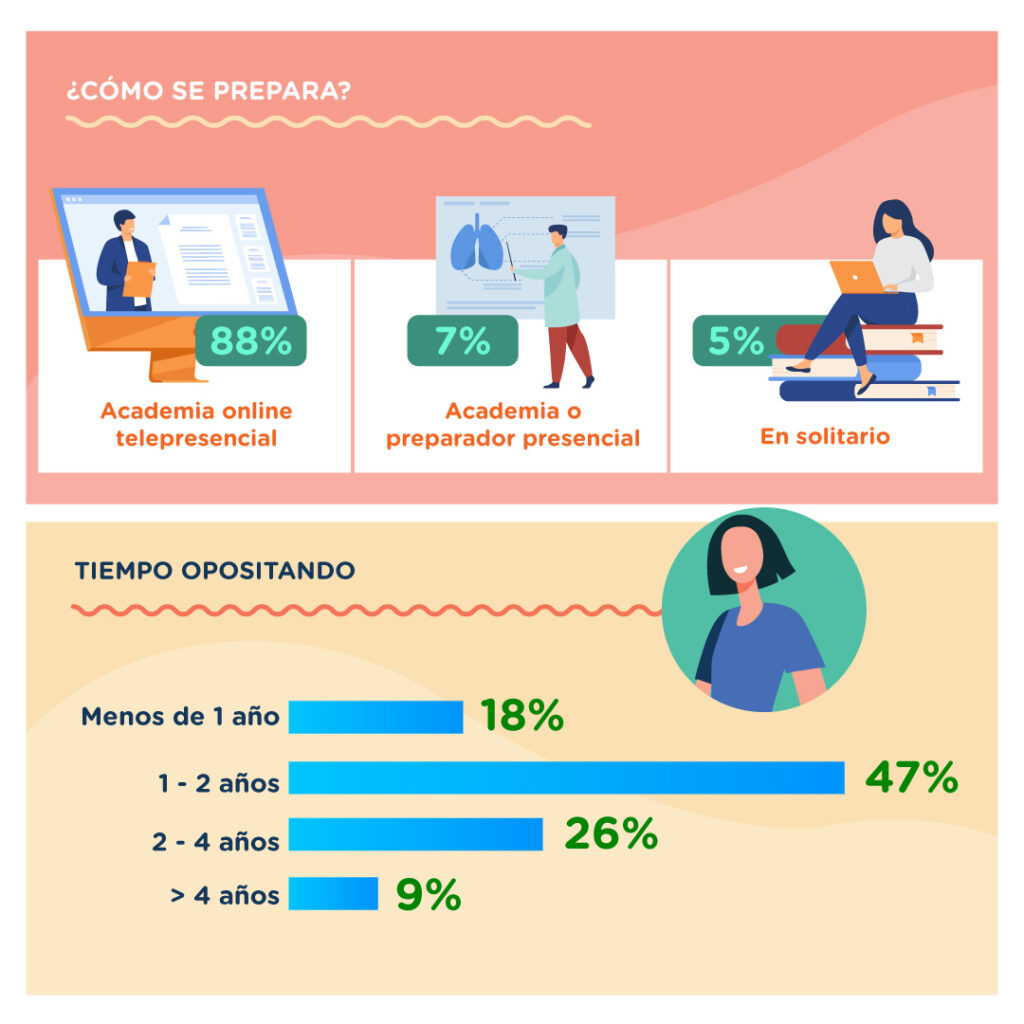
Otra pregunta frecuente es «¿en cuánto tiempo puedo sacarme mi plaza?«. En GoFIR Titulares hemos tenido alumnos que han conseguido su plaza de funcionario de carrera en unos 8 meses de formación (no son la mayoría). Y un número considerable en el intervalo de 10 a 14 meses de estudio. Aunque siempre, nuestra recomendación para alguien que decide iniciarse como opositor, es plantearse un horizonte de estudio de al menos 2-3 años. Hay que tener en cuenta que la gran inversión que vamos a realizar no es económica, sino de horas de estudio, y estas horas deben amortizarse con varios intentos con los que tener más probabilidades de conseguir nuestra plaza. Si es a la primera, ¡pues mucho mejor! Como media, la gran mayoría de opositores que obtienen plaza están en torno a los 2 años de estudio.
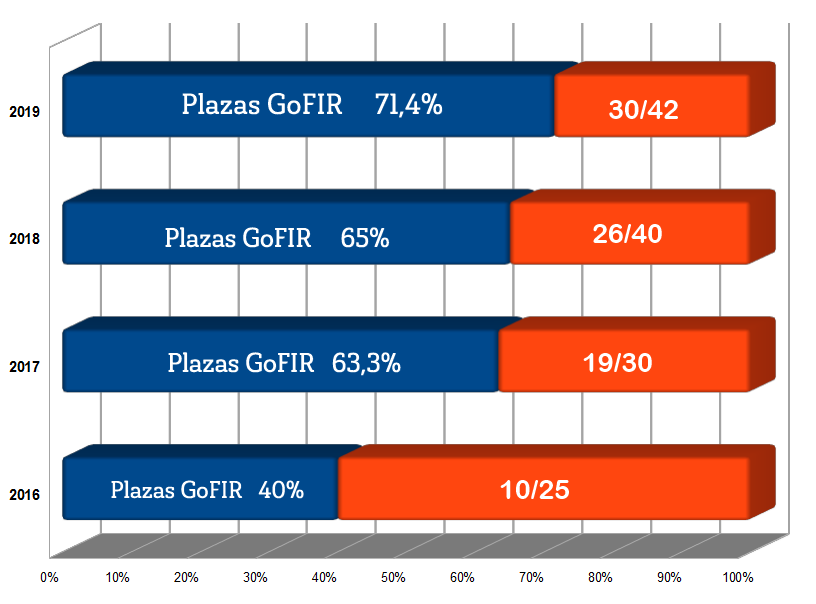
El dato estadístico que más valor proporciona a la hora de hacer una comparativa respecto a la competencia que vamos a tener, es el número de opositores que superan el primer ejercicio. Éstos fueron de media unos 82, frente a las 43 plazas de media ofertadas en los últimos seis años. Es decir, aunque se inscriban en la oposición de 500 a 600 al año, no habrá más de 100 opositores con garantías reales de superar todo el proceso selectivo. Un ratio que mejora el 2:1 ya desde el primer ejercicio. Esto no se ve en muchas oposiciones.
En academia GoFIR disponemos de la mejor formación telepresencial, con una plataforma única y novedosa, en la que se integra toda la formación en un único acceso, con material dinámico en la nube, y con el mejor perfil de profesorado activo en nuestro cuerpo. A esto se le añade, desde el último año, la posibilidad de obtener el Master de Inspección Farmacéutica y regulación de medicamentos, emitido por la universidad UDIMA.
Mucho ánimo opositores, y nos vemos en GoFIR!!
- —————————TEMAS RELACIONADOS ————————
- Tema 14. Régimen jurídico del personal al servicio de las Administraciones Públicas. El Texto refundido del Estatuto Básico del Empleado Público. Derechos y deberes del personal al servicio de la Administración Pública. Incompatibilidades. Los profesionales del Sistema Nacional de Salud: Ley 44/2003, de 21 de noviembre, de ordenación de las profesiones sanitarias.
- Tema 18. El Ministerio de Sanidad. Estructura y competencias. La Secretaría General de Sanidad y las Direcciones Generales adscritas: estructura y funciones. El Ministerio de Consumo. Estructura y competencias. La Agencia Española de Seguridad Alimentaria y Nutrición: estructura y funciones. La Agencia Española de Medicamentos y Productos Sanitarios: estructura y funciones.
- Tema 19. La Ley 14/1986, de 25 de abril, General de Sanidad. El Sistema Nacional de Salud. La ordenación de las prestaciones sanitarias. Los niveles asistenciales: asistencia primaria y asistencia especializada. Coordinación general sanitaria. El Consejo Interterritorial del Sistema Nacional de Salud.
- Tema 32. Los servicios periféricos de inspección farmacéutica: organización y funciones. Comercio exterior de medicamentos, principios activos empleados en la fabricación de medicamentos, productos sanitarios, cosméticos y productos de cuidado personal.