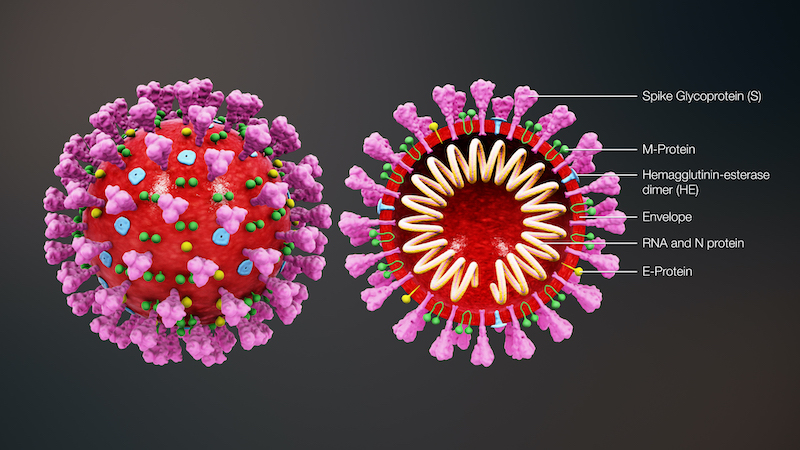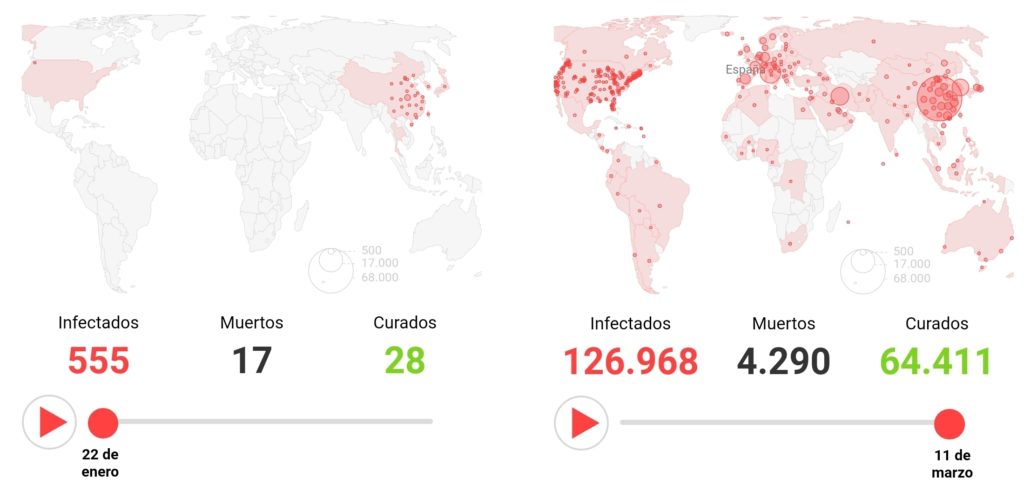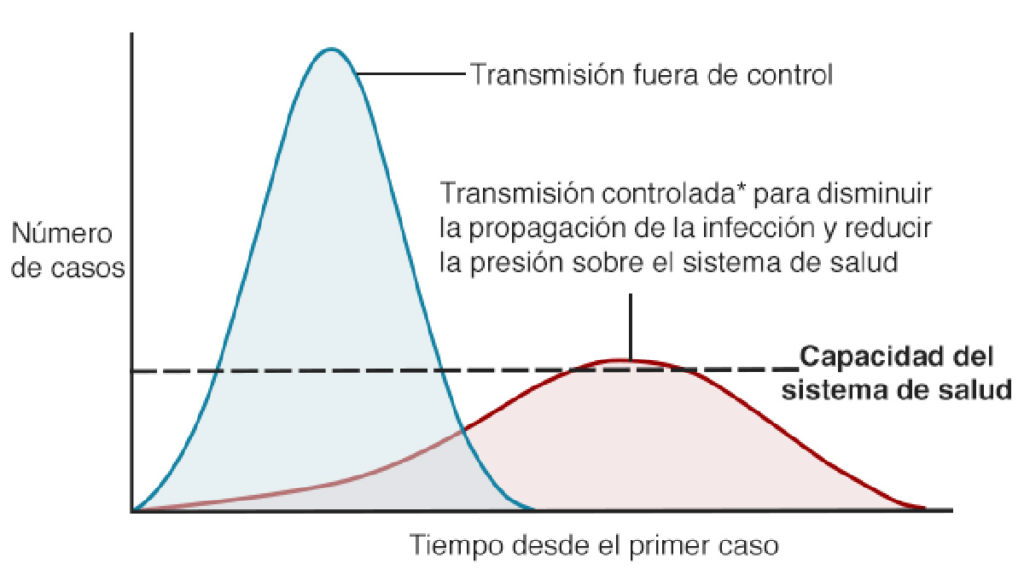
A fecha de entrada de este artículo, existen 114 ensayos clínicos activos en diferentes fases de investigación. Dos de ellos se encuentran en la fase II, de las tres fases necesarias para poder obtener la autorización de las agencias, y ser comercializada.
Durante las últimas semanas, los medios de comunicación han reiterado una pregunta respecto a la actual pandemia del coronavirus Sars-Cov-2, ¿cuándo estará disponible una vacuna efectiva?
Lo cierto es que la respuesta es bastante compleja, ya que desde inicio se podía responder: de forma acelerada sería posible en 6-7 meses (comprometiendo en este sentido su seguridad); lo habitual es un periodo medio de 48-60 meses para un nuevo patógneo; incluso puede ocurrir que no consigan dar con una vacuna lo suficientemente efectiva como para generar la inmunidad apropiada y generalizada, cuando se distribuya masivamente a la población.
Para esto son esenciales los ensayos clínicos, que testearán la generación de anticuerpos frente al virus, y su tipo. Y es aquí donde ya se pueden anunciar (con cautela) las primeras buenas noticias al respecto. Y es que las vacunas en ensayos más avanzados han conseguido elevar la tasa de anticuerpos a niveles similares a los que genera la propia enfermedad. No obstante, estos datos hay que tomarlos con cierta precaución, ya que los coronavirus no son una familia de virus precisamente caracterizados por generar una inmunogenicidad elevada y sostenida en el tiempo.
- Existen 4 procedimientos de autorización de una vacuna en España:
1.- Centralizado (Reglamento 726/2004): la Agencia Europea de medicamentos (EMA) es la responsable de la evaluación y autorización del medicamento para el mercado único europeo, coordinando las autorizaciones nacionales de los 25 estados miembros, más Islandia, Noruega y Liechtenstein.
2.- Descentralizado (Directiva 2001/83; 2004/27): la compañía presenta la solicitud de autorización de comercialización al Estado Miembro de Referencia (EMR) y a los distintos Estado Miembros Concernidos (EMC) simultáneamente, los cuales elaboran y evalúan la autorización de comercialización.
3.- Reconocimiento Mutuo (Directiva 2001/83; 2004/27): la compañía posee la autorización de comercialización nacional en un Estado (por lo general EMR) y presenta, posteriormente, la solicitud de autorización de comercialización a distintos EMC.
4.- Nacional (Real Decreto 1345/2007), autorización por la AEMPS para la puesta en mercado de cualquier medicamento en España.
Aunque vacunas recurrentes, como la de la gripe, pueden ser autorizadas por procedimiento Nacional (AEMPS), el Reglamento 726/2008 en su Anexo nos indica:
ANEXO: MEDICAMENTOS QUE DEBEN SER OBJETO DE UNA AUTORIZACIÓN COMUNITARIA
…
3. Medicamentos de uso humano que contengan una sustancia activa nueva que, en la fecha de entrada en vigor del presente Reglamento, no estuviera autorizada en la Comunidad y cuya indicación terapéutica sea el tratamiento de alguna de las enfermedades siguientes:
– el síndrome de inmunodeficiencia adquirida
– el cáncer
– los trastornos neurodegenerativos
– la diabetes,
y con efectos a partir de 20 de mayo de 2008:
– las enfermedades autoinmunes y otras disfunciones inmunes
– las enfermedades víricas.
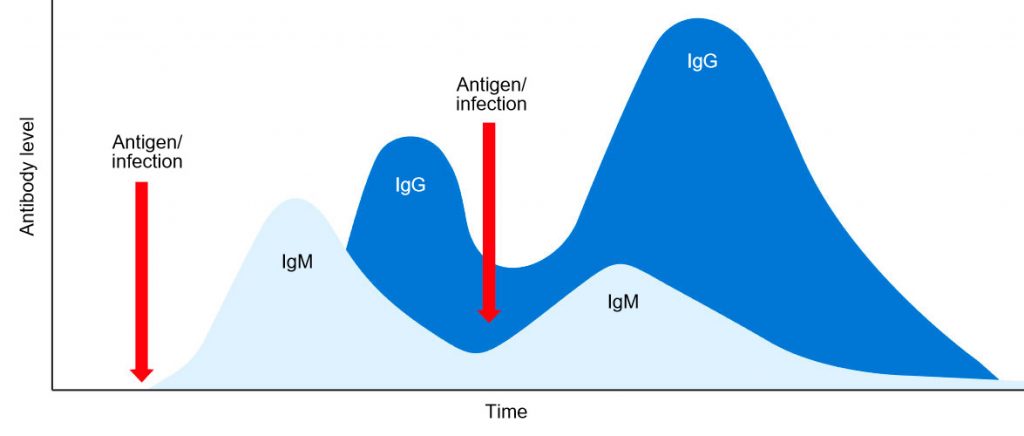
Nuestros alumnos, por el Tema 65: TIPOS Y UTILIZACIÓN DE VACUNAS DE USO HUMANO. TIPOS Y UTILIZACIÓN TERAPÉUTICA DE INMUNOGLOBULINAS, ya conocen los tipos de respuesta inmunológica que se produce en el organismo:
1.- Respuesta primaria: tras la administración de la vacuna prosigue un período de latencia de duración variable (2-4 días), durante el cual no se detectan anticuerpos en el suero. Posteriormente aparece la respuesta primaria, en la que aparecen anticuerpos séricos, principalmente IgM, cuya tasa crece de forma exponencial, alcanzando su nivel máximo en un tiempo variable que oscila de 4 días a 4 semanas, y que va descendiendo durante las semanas siguientes, hasta llegar a niveles muy bajos o casi indetectables.
2.- Respuesta secundaria: tras la respuesta primaria hay un período de memoria inmunológica durante el cual, si volvemos a administrar otra dosis de vacuna, se va a obtener una respuesta secundaria caracterizada principalmente por una producción de anticuerpos del tipo IgG, mucho más rápida y a concentraciones más altas, que van a permanecer en suero más tiempo. También existe la posibilidad de conseguir una respuesta secundaria consolidada sólo con una administración inicial, o sólo con superar una vez la enfermedad (en función del tipo de vacuna y tipo de patógeno).
Actualmente, las líneas de actuación sobre la creación de una vacuna eficaz, tal y como se desarrolla en nuestro tema, y como bien esquematiza la Sociedad Española de Virología, estarían basadas en: virus vivos atenuados o virus inactivos, vectores virales replicativos y no replicativos, partículas víricas, proteínas del virus (proteína S trimérica, fragmentos proteícos (S1, RBD…), péptidos), y vacunas basadas en ARN.

También a través del Tema 16: «Los procedimientos para la autorización y registro de medicamentos en la Unión Europea y en España. Procedimiento centralizado. Procedimiento descentralizado y reconocimiento mutuo. Procedimiento nacional. El Comité de Medicamentos de Uso Humano. Estructura y funciones«, sabemos que el Real Decreto 1345/2007, en su Anexo I Parte III (vacunas y medicamentos biológicos), se establecen los siguientes unos requisitos específicos para vacunas, como:
– Incluir un archivo principal sobre un antígeno de vacuna (VaMF): el cual constituye una parte independiente del expediente de solicitud de autorización de comercialización que contendrá toda la información pertinente de naturaleza biológica, farmacéutica y química relativa a cada uno de los principios activos que forman parte del medicamento:
- Cada vacuna puede contener uno o varios antígenos distintos. Cada vacuna contiene tantos principios activos como antígenos.
- Una vacuna combinada contiene como mínimo dos antígenos distintos destinados a la prevención de una o varias enfermedades infecciosas.
- Una vacuna monovalente contiene un solo antígeno destinado a la prevención de una sola enfermedad infecciosa.
También el artículo 43 del Real Decreto 1345/2007 nos describe la autorización previa de lotes de fabricación de vacunas:
1. Por motivos de salud pública, la Agencia Española de Medicamentos y Productos Sanitarios someterá a autorización previa cada lote de fabricación de producto terminado de vacunas y condicionará la comercialización a su conformidad.
Como podemos ver, el desarrollo de vacunas es un proceso de enorme complejidad que suele necesitar varios años y una gran inversión económica.
Hasta ahora, el récord en el desarrollo de una vacuna contra un virus nuevo lo ostenta la vacuna contra las paperas (paramixovirus, virus ARN), que requirió «tan solo» cuatro años. Si la vacuna contra el coronavirus se desarrollase en año o año y medio sería todo un hito histórico para la humanidad. Los avances científicos, los esfuerzos globales de investigadores, reguladores y sanitarios y el conocimiento previo con otros coronavirus podría hacerlo posible.
La gran apuesta económica por la investigación de una vacuna sigue sin permitir acelerar los complejos procesos de I+D necesarios para que este tratamiento llegue a comercializarse de forma segura y eficaz.
Aunque sí es cierto que puede incrementar las probabilidades de éxito de obtener una vacuna efectiva, pues cuantas más vacunas candidatas existan, mayores oportunidades habrá de que una o varias de ellas sean efectivas. Sin embargo, tampoco esto asegura una certeza de que se vaya a conseguir tener una vacuna efectiva y definitiva. La vacuna del VIH (causante del SIDA), por ejemplo, lleva investigándose desde hace 30 años con una inversión multimillonaria, y todavía no se ha conseguido ninguna que sea eficaz.
Los resultados iniciales son prometedores, pero todavía hay que tener cautela, confiar en nuestra ciencia, y en la enorme cantidad de profesionales y equipos multidisciplinares que actualmente trabajan en la sombra y sin descanso, en aquello que podría devolver una normalidad a nuestro mundo en un corto o medio plazo.
¡Ánimo a todos, y nos vemos en GoFIR!
- _____________TEMAS RELACIONADOS_______________
- Tema 65. Tipos y utilización de vacunas de uso humano. Tipos y utilización terapéutica de inmunoglobulinas.
- Tema 16. Los procedimientos para la autorización y registro de medicamentos en la Unión Europea y en España. Procedimiento centralizado. Procedimiento descentralizado y reconocimiento mutuo. Procedimiento nacional. El Comité de Medicamentos de Uso Humano. Estructura y funciones.
- Tema 18. La autorización de medicamentos genéricos. La autorización de medicamentos con condiciones especiales respecto a su prescripción y dispensación. Real Decreto 1015/2009, de 19 de junio, por el que se regula la disponibilidad de medicamentos en situaciones especiales.
- Tema 23. Los servicios periféricos de inspección farmacéutica: organización y funciones.
- Tema 26. El Ministerio de Sanidad, Consumo y Bienestar Social. Estructura, competencias y funciones. Dirección General de Salud Pública, Calidad e Innovación. Estructura y funciones. Dirección General de Cartera Básica de Servicios del Sistema Nacional de Salud y Farmacia. Estructura y funciones. La Agencia Española de Seguridad Alimentaria y Nutrición. Estructura y funciones. La Agencia Española de Medicamentos y Productos Sanitarios. Estructura y funciones.
- Tema 27. La Agencia Europea de Medicamentos. Base jurídica, estructura y funciones. Coordinación con las autoridades de los Estados miembros. Bases de datos de la Agencia Europea de Medicamentos. Comités y grupos de trabajo de la Comisión Europea relacionados con medicamentos.
- Tema 10. La Organización Mundial de la Salud (OMS): Estructura y funciones. Oficinas Regionales. La Organización Panamericana de la Salud. Principales programas y actividades relacionadas con medicamentos.
- Tema 33. Comercio exterior de medicamentos, principios activos empleados en la fabricación de medicamentos, productos sanitarios, cosméticos y productos de cuidado personal.
- Tema 29. La asistencia sanitaria en el Sistema Nacional de Salud. La ordenación de las prestaciones sanitarias. Los niveles asistenciales en el Sistema Nacional de Salud: Asistencia primaria y asistencia especializada.
- Tema 22. Ley 14/1986, de 25 de abril, General de Sanidad. Estructura. Fundamentos básicos. Las competencias sanitarias del Estado y de las Comunidades Autónomas. Coordinación general sanitaria. El Consejo Interterritorial del Sistema Nacional de Salud. Ley 33/2011, de 4 de octubre, General de Salud Pública.