El pasado mes de mayo tuvo la resolución del último gran concurso del Ministerio de Política Territorial para la movilidad de funcionarios de las Áreas de Sanidad de la administración periférica del Estado, entre los que participa el Cuerpo de Farmacéuticos Titulares del Estado.

El pasado 9 de diciembre se publicó el BOE la provisión de puestos de trabajo vacantes a los que optar por concurso en los diferentes cuerpos de las Áreas de Sanidad de las Delegaciones del Gobierno en cada provincia.
https://www.boe.es/boe/dias/2022/12/09/pdfs/BOE-A-2022-20822.pdf
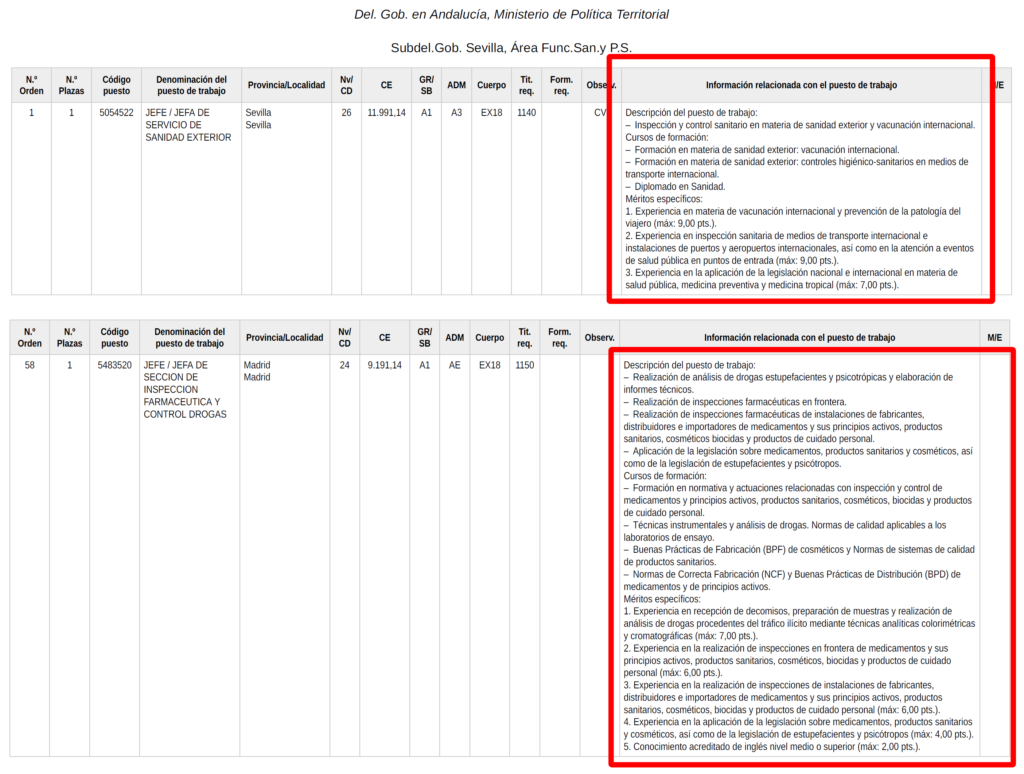
La idea principal de esta publicación es que todos aquellos que ostenten la plaza como funcionario de carrera del cuerpo de Farmacéuticos Titulares puedan comprobar y analizar los diferentes requisitos y baremos solicitados en este tipo de concursos:
Estos concursos tienen en cuenta el principio de igualdad de trato entre mujeres y hombres y se basa en los acuerdos negociados en la Mesa General de Negociación de la Administración General del Estado.
Los funcionarios pertenecientes a distintos Cuerpos o Escalas solo podrán participar desde uno de ellos y los funcionarios con exclusiones podrán participar en aquellos puestos que tengan clave de exclusión siempre que se les permita.
El baremo de valoración del concurso consta de dos fases: la primera valora los méritos generales y la segunda los méritos específicos. Para ser elegible para un puesto de trabajo, se requiere una puntuación mínima de 15 puntos en la primera fase y 10 puntos en la segunda. Los méritos se valorarán con referencia a la fecha de cierre del plazo de presentación de instancias. La primera fase valora el grado personal consolidado del candidato en su Cuerpo o Escala de origen (a partir de 2 años dentro de una misma plaza de destino). En el caso de reconocimiento de un grado en otras Administraciones Públicas o en la Sociedad Estatal de Correos y Telégrafos, se valorará en función del intervalo de niveles establecido por el artículo 71.1 del Real Decreto 364/1995.
La valoración de los méritos en la selección de personal en una convocatoria incluye dos fases: la primera para el cuidado de hijos e hijos o familiares, y la segunda para los méritos específicos adecuados a las características del puesto.
En la primera fase, el cuidado de hijos e hijos o familiares se valorará con un máximo de 5 puntos. Se valorarán 3 puntos si la plaza por la que se opta está en la misma provincia que el menor, 2 puntos si está en el mismo municipio, y 1 punto en cualquier otro caso. Además, se pueden sumar 1 punto si el hijo cuenta con un grado de discapacidad o si es una familia monoparental o numerosa.
En el cuidado de un familiar, se valorará con hasta 5 puntos, siendo 4 puntos para el primer grado de consanguinidad o afinidad y 2 puntos para el segundo grado. Además, se puede sumar 1 punto si el familiar cuenta con un grado de discapacidad superior al 65%.
En la segunda fase, se valorarán los méritos específicos adecuados a las características del puesto, con un máximo de 25 puntos. Los méritos incluyen experiencia profesional, formación, capacidad lingüística, y otros que se especifiquen en la convocatoria.

La documentación que se requiere para acreditar los supuestos relacionados con la conciliación de la vida personal, familiar y laboral incluye:
- Copia del Libro de Familia o certificación actualizada del Registro Civil de inscripción matrimonial y una certificación de la unidad de personal que acredite la relación de servicios del cónyuge.
- Para el cuidado de hijos e hijas, se requiere una copia del Libro de Familia o de la resolución administrativa o judicial de la adopción, acogimiento permanente o preadoptivo. También se puede requerir un certificado de escolarización, documentación acreditativa de la mejor atención del menor o menores y un certificado de empadronamiento actualizado que acredite la residencia del funcionario o funcionaria en el mismo municipio en el que se ubica su puesto de trabajo.
La octava parte de las bases establece el procedimiento de exclusión de los participantes en el concurso. Si un participante obtiene un puesto con carácter definitivo antes de la resolución del concurso, deberá comunicarlo al órgano convocante o será excluido de oficio. Después del plazo de presentación de solicitudes, el órgano convocante excluirá a aquellos participantes que no cumplan con los requisitos establecidos en la convocatoria. La lista de exclusiones será publicada en la página web del departamento. Tanto la renuncia parcial como el desistimiento de la solicitud se permitirán hasta dos días antes de la publicación de los listados provisionales de valoración de las solicitudes.
La novena parte describe la publicación de la valoración de los méritos por parte de la Comisión de Valoración en la página web del departamento, con un periodo de alegaciones de cinco días hábiles.
La décima parte describe la resolución del concurso, que se hará por resolución de la Subsecretaría de Política Territorial y será publicada en el Boletín Oficial del Estado. La resolución deberá estar motivada y se hará indicación explícita del puesto de trabajo, la localidad, el órgano directivo y el departamento o administración correspondiente.
ESTABILIZACIÓN:
https://www.boe.es/boe/dias/2022/12/30/pdfs/BOE-A-2022-23833.pdf
El proceso selectivo de estabilización de empleo público temporal se lleva a cabo mediante un concurso de valoración de méritos, en el que los participantes podrán obtener un máximo de 100 puntos. 60 puntos de estos puntos se otorgarán en base a los servicios profesionales prestados, siendo valorados de acuerdo a un baremo específico. 40 puntos más se otorgarán por méritos académicos y superación de ejercicios selectivos, con un baremo específico para cada uno.
RESOLUCIÓN:
https://www.boe.es/boe/dias/2023/06/03/pdfs/BOE-A-2023-13222.pdf
El pasado 3 de junio se publicó en BOE la resolución de este concurso, con la publicación de las plazas y sus destinatarios. Puedes consultarlo todo en el anexo de la publicación del enlace de más arriba.
Analizar este tipo de consursos nos permite poder ir en mejor previsión de formación de cara a posteriores convocatorias en las que estuviéramos interesados en la movilidad geográfica de nuestra plaza como funcionarios de carrera.
¡Mucho ánimo a todos, y nos vemos en GoFIR!