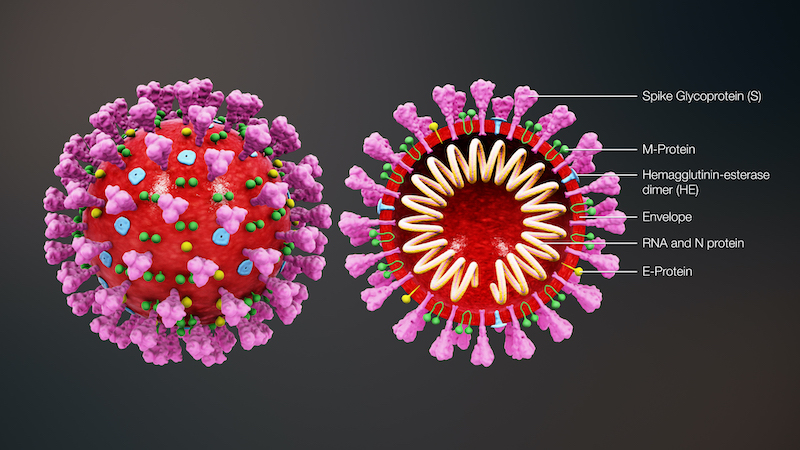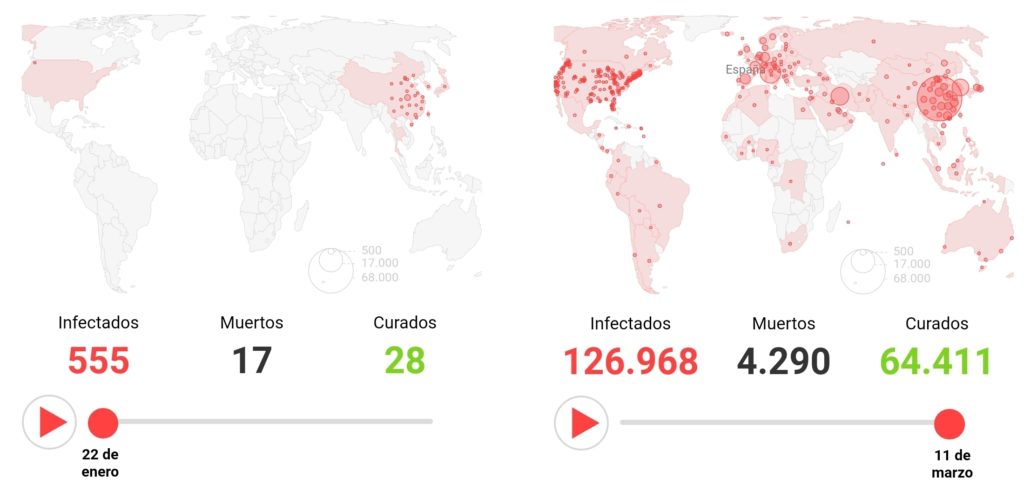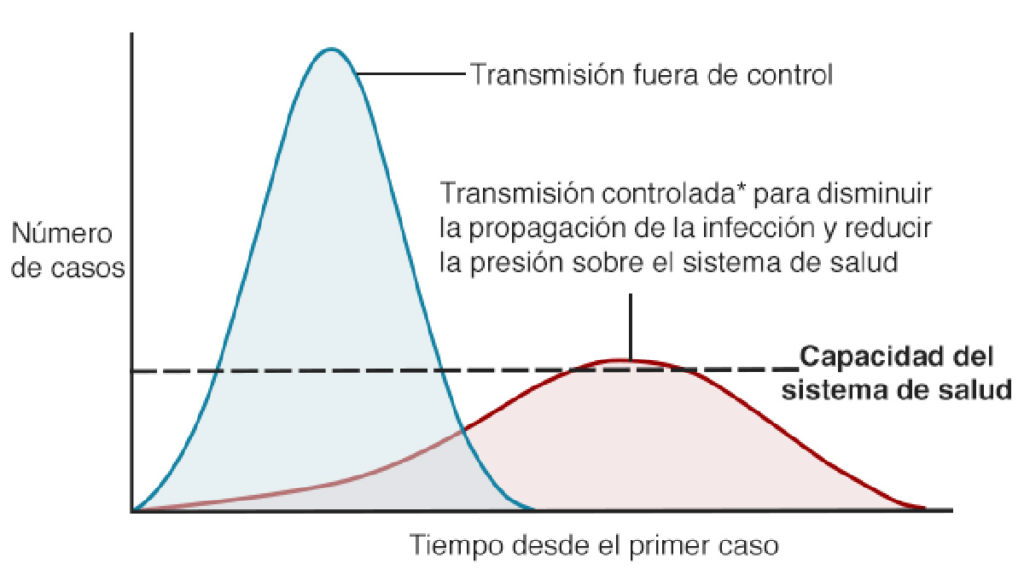
La Agencia Española de Medicamentos y Productos Sanitarios ha publicado los fármacos que actualmente han demostrado alguna eficacia frente a Covid-19.
El Ministerio de Sanidad ha elaborado un protocolo para el manejo y tratamiento de los pacientes con infección por SARS-CoV-2 (Covid-19) que se actualiza permanentemente. Pero también ha actualizado los medicamentos disponibles para la infección por SARS-CoV-2.
Algunos de los tratamientos disponibles son medicamentos ya autorizados en otras indicaciones para los que se ha demostrado eficacia en covid-19. De dicho documento cabe destacar los siguientes puntos importantes:
- NO existe por el momento evidencia procedente de ensayos clínicos controlados que permitan recomendar un tratamiento específico para SARS-CoV-2.
- La AEMPS está monitorizando de manera continua con los expertos de las agencias europeas, la EMA y otras agencias fuera de la Unión Europea todos los datos relativos al uso de medicamentos para el tratamiento o la profilaxis de la infección respiratoria por SARS-CoV-2.
- Hasta la fecha, solo hay datos parciales, preliminares, a veces únicamente in vitro o incluso contradictorios, sobre la eficacia de uno u otro producto por lo que, en la medida de lo posible, debe priorizarse la posibilidad de realizar estudios clínicos que, al tiempo que ofrecen una alternativa de tratamiento plausible, generen conocimiento útil.
- En estos momentos, se están poniendo en marcha diversos ensayos clínicos en España para el tratamiento de la infección respiratoria por SARS-CoV-2.
A continuación se recogen aquellos tratamientos que se han venido utilizando en alguna de las estrategias terapéuticas puestas en marcha en relación a la infección respiratoria por SARS-CoV-2, y que han obtenido resultados positivos por diversos profesionales sanitarios (estos tratamientos no deben ser considerados en ningún caso como una recomendación de uso o priorización de uso por parte de la Agencia):
- Remdesivir: s un análogo de nucleótido no autorizado en España, que interfiere con la polimerización del ARN del virus. Se desarrolló inicialmente como tratamiento para la enfermedad del virus del Ébola, pero presenta también actividad in vitro frente a éste y otros virus, incluyendo el coronavirus.
- Lopinavir/Ritonavir (LPV/r): es un inhibidor de la proteasa del VIH indicado en combinación con otros agentes antiretrovirales para el tratamiento del VIH en adultos y en población pediátrica desde los 14 días de edad. Es un medicamento comercializado en España.
- Cloroquina/Hidroxicloroquina: son medicamentos inicialmente utilizados como antimaláricos que, posteriormente, han encontrado su mayor uso en el contexto de diferentes enfermedades autoinmunes. La cloroquina parece ser efectiva para limitar la replicación del SARS-CoV-2 in vitro. Actualmente la única presentación disponible en España es RESOCHIN 155 mg comprimidos recubiertos.
- Tocilizumab (TCZ): es un agente inmunosupresor, inhibidor de la IL-6, autorizado para el tratamiento de la artritis reumatoide y el síndrome de liberación de citosinas asociado al tratamiento con CART. El 3 de marzo de 2020, Tocilizumab (TCZ) se incluyó en el séptimo plan actualizado de diagnóstico y tratamiento para SARS-CoV-2 emitido por la Comisión Nacional de Salud de China. Alrededor de 500 pacientes con SARS-CoV-2 han sido tratados con TCZ en Wuhan. Sin embargo, TCZ no ha recibido la aprobación de la autoridad sanitaria para esta indicación en ningún país. Está autorizado en España.
- Sarilumab: es un agente inmunosupresor, inhibidor de la IL-6, autorizado para el tratamiento de la artritis reumatoide activa de moderada a grave en pacientes adultos. En base a que el aumento de citoquinas pro-inflamatorias se ha asociado con la gravedad y la mortalidad de la neumonía por otros coronavirus (MERS y SARS), en estos momentos se está explorando si el uso de otros anti IL-6 puede reducir la morbilidad/mortalidad de la neumonía por SARS-CoV-2.
- Interferón Beta-1B (IFNb) e Interferón Alfa-2B: algunas observaciones clínicas en humanos y animales han mostrado que la infección por el MERS-CoV está mediada por la replicación del virus y por la respuesta inflamatoria del hospedador14. Esto condujo al estudio de los dos tipos de interferones (1 y 2), que mostraron actividad in vitro.
También debemos destacar la actual labor del Centro Militar de Farmacia de la Defensa, en Colmenar Viejo, y en el que actualmente tenemos a compañeras del cuerpo de Farmacéuticos Titulares del Estado. Desde el punto de vista de la producción farmacéutica, este centro lleva a cabo la fabricación de aquellos medicamentos que son necesarios para atender las necesidades de las Fuerzas Armadas, en el aspecto logístico-operativo, y en el asistencial.

Pero dentro del actual estado de alarma, el Ministerio de Defensa ha dado la orden para que Farmacia militar, y en concreto este Centro, lleve a cabo la elaboración de hidrogel desinfectante, Paracetamol, el antiviral Ribavirina, y la solución inactivadora del coronavirus, a petición del Centro Nacional de Biotecnología del CNIC.
Estamos viviendo momentos duros, y que van a quedar para la historia. Y los profesionales sanitarios, así como todo el personal que estamos al servicio del Ministerio de Sanidad, Agencia Española de Medicamentos y Productos Sanitarios, Sanidad Exterior, Centro Militar de Farmacia… debemos estar a la altura en este desafío en el que actualmente se encuentra nuestra sociedad. #EsteVirusLoParamosUnidos
Ánimo a todos, y nos vemos en GoFIR!
- —– TEMAS RELACIONADOS ————–
- Tema 60. Medicamentos antifúngicos. Utilización terapéutica. Medicamentos antiparasitarios. Utilización terapéutica.
- Tema 61. Clasificación y mecanismo de acción de los fármacos antivirales. Usos terapéuticos. Fármacos antirretrovirales y manejo de la infección por VIH.
- Tema 64. Inmunodepresores y moduladores de la inmunidad. Farmacología del rechazo de trasplantes. Uso terapéutico de interferones. Modalidades y perspectivas.
- Tema 65. Tipos y utilización de vacunas de uso humano. Tipos y utilización terapéutica de inmunoglobulinas.
- Tema 33. Comercio exterior de medicamentos, principios activos empleados en la fabricación de medicamentos, productos sanitarios, cosméticos y productos de cuidado personal.
- Tema 18. La autorización de medicamentos genéricos. La autorización de medicamentos con condiciones especiales respecto a su prescripción y dispensación. Real Decreto 1015/2009, de 19 de junio, por el que se regula la disponibilidad de medicamentos en situaciones especiales.
- Tema 23. Los servicios periféricos de inspección farmacéutica: organización y funciones.
- Tema 26. El Ministerio de Sanidad, Consumo y Bienestar Social. Estructura, competencias y funciones. Dirección General de Salud Pública, Calidad e Innovación. Estructura y funciones. Dirección General de Cartera Básica de Servicios del Sistema Nacional de Salud y Farmacia. Estructura y funciones. La Agencia Española de Seguridad Alimentaria y Nutrición. Estructura y funciones. La Agencia Española de Medicamentos y Productos Sanitarios. Estructura y funciones.
- Tema 27. La Agencia Europea de Medicamentos. Base jurídica, estructura y funciones. Coordinación con las autoridades de los Estados miembros. Bases de datos de la Agencia Europea de Medicamentos. Comités y grupos de trabajo de la Comisión Europea relacionados con medicamentos.
- Tema 10. La Organización Mundial de la Salud (OMS): Estructura y funciones. Oficinas Regionales. La Organización Panamericana de la Salud. Principales programas y actividades relacionadas con medicamentos.
- Tema 29. La asistencia sanitaria en el Sistema Nacional de Salud. La ordenación de las prestaciones sanitarias. Los niveles asistenciales en el Sistema Nacional de Salud: Asistencia primaria y asistencia especializada.
- Tema 22. Ley 14/1986, de 25 de abril, General de Sanidad. Estructura. Fundamentos básicos. Las competencias sanitarias del Estado y de las Comunidades Autónomas. Coordinación general sanitaria. El Consejo Interterritorial del Sistema Nacional de Salud. Ley 33/2011, de 4 de octubre, General de Salud Pública.