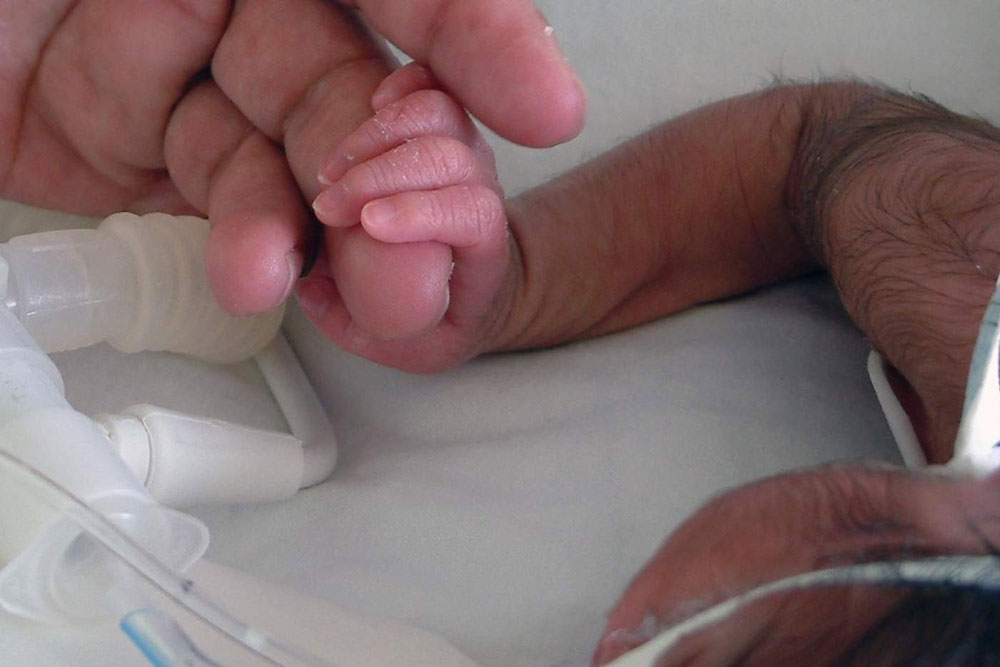
Una confusión en un lote granel provoca el síndrome del hombre lobo en 14 bebés andaluces.
Cuando estudiamos el bloque de calidad farmacéutica, sistemas de control y garantía de la calidad, muchos de los criterios y requisitos que se exponen pueden parecernos obvios, de sentido común. Pero cado poco tiempo aparece una nueva noticia que hace saltar por los aires todo ese «sentido común».
La Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) ordenó el pasado 8 de agosto la retirada de un lote de omeprazol defectuoso que provocaba hipertricosis, un exceso de vello que ha afectado a catorce bebés de Andalucía, causado por el principio activo distribuido en una treintena de farmacias. Por supuesto, no era el fármaco omeprazol el que estaba provocando esa hipertricosis.
El Consejo General de Colegios Oficiales de Farmacéuticos comunicó a cada comunidad autónoma la alerta detectada por AEMPS, que ordenó la retirada de las farmacias y hospitales andaluces de todos los lotes de omeprazol de Farma-Química Sur SL.
Este fármaco prescrito para bebés con reflujo, en forma de fórmula magistral elaborada en farmacias, ha provocado hipertricosis en al menos catorce menores de un año en Andalucía. Aunque algunas noticias en prensa hablaban de «contaminación del omeprazol», no es así. Se trataba de una confusión en el etiquetado del lote, indicando como «omeprazol» lo que realmente era «minoxidil», un principio activo indicado para la alopecia. Se han detectado un total de 22 lotes con orden de retirada. Puedes consultar aquí la alerta completa emitida por la AEMPS: Defectos de calidad
A su vez, esta empresa compraba el principio activo a otra ubicada en la India. En estos casos, es el importador el responsable de realizar los pertinentes controles de calidad sobre la materia prima importada. Según el control sanitario en frontera de productos farmacéuticos, los lotes del supuesto omeprazol requieren de inspección de farmacia en aduana previa a la importación (FARMIN). Pero estos controles suelen realizarse sobre identidad, y no con muestreo físico en aduana (salvo campañas específicas). Por lo que se liberaría en la aduana de nuestro país como su etiquetado indicaba: «omeprazol».
Como bien saben nuestros alumnos, se trata de una retirada con un defecto de calidad de los más graves, según clasifica la AEMPS (Clase 1):
CLASE 1: defectos que constituyen un peligro potencial y grave riesgo para la salud de los pacientes. Algunos ejemplos serían:
- La localización de un producto incorrecto (por ejemplo, cuando la etiqueta no se corresponde con el contenido).
- La localización de un producto correcto pero con falta de actividad, con graves consecuencias clínicas.
- La contaminación microbiana de un producto estéril inyectable u oftálmico.
La empresa Farma-Química Sur S.L., a raíz de esta incidencia y las inspecciones llevadas a cabo a sus instalaciones, tiene suspendido su registro para realizar las actividades de fabricación, importación y/o distribución de principios activos farmacéuticos (https://labofar.aemps.es/labofar/registro/ruesa/consulta.do)
Por todo esto, y aunque parezca de sentido común todo lo que se expone y repite sobre el control de calidad en la fabricación, el flujo de personas y materiales, la distribución en las instalaciones, los etiquetados de recintos, estanterías y material, sistemas de almacenamiento, auditorías internas, sistemas de retirada, etc… siempre habrá que valorarlo en su medida, y darle la importancia que merece. Porque esta vez ha sido minoxidil, pero en otro caso en el futuro no sabemos qué principio activo podría ser el incluido en una fatídica confusión.
- TEMARIO RELACIONADO:
- Tema 23. Real Decreto Legislativo 1/2015, de 24 de julio, por el que se aprueba el texto refundido de la Ley de garantías y uso racional de los medicamentos y productos sanitarios.
- Tema 27. La Agencia Europea de Medicamentos. Base jurídica, estructura y funciones. Coordinación con las autoridades de los Estados miembros. Bases de datos de la Agencia Europea de Medicamentos. Comités y grupos de trabajo de la Comisión Europea relacionados con medicamentos.
- Tema 24. Laboratorios farmacéuticos y fabricantes, importadores y distribuidores de principios activos. Real Decreto 824/2010, de 25 de junio, por el que se regulan los laboratorios farmacéuticos, los fabricantes de principios activos de uso farmacéutico y el comercio exterior de medicamentos y medicamentos en investigación.
- Tema 25. Normas de correcta fabricación de medicamentos (I): Requisitos básicos para los medicamentos: Sistema de calidad farmacéutico, Personal, Instalaciones y Equipos, Producción. Control de calidad, Subcontratación de Actividades, Reclamaciones y retiradas.
- Tema 31. Seguimiento de la calidad del medicamento comercializado, toma de muestras y análisis. Actuaciones ante defectos de calidad.
- Tema 33. Comercio exterior de medicamentos, principios activos empleados en la fabricación de medicamentos, productos sanitarios, cosméticos y productos de cuidado personal.
- Tema 1. Farmacovigilancia: Conceptos, objetivos y bases legales. Buenas Prácticas de Farmacovigilancia. Control de calidad: inspecciones.
- Tema 3. La distribución de medicamentos en la Unión Europea y su regulación en España. Normativa aplicable. Buenas prácticas de distribución de medicamentos. Distribución paralela.
- Tema 53. Farmacología clínica de antiácidos y antiulcerosos. Medicamentos reguladores de la motilidad gastrointestinal. Utilización terapéutica.